Overfladespænding
Overfladespænding i sæbebobler øges af vandet og sænkes af sæben

Rent vand skal bruge sæbe for at lave bobler
Prøv et simpelt eksperiment: Dyp en wand i rent vand i stedet for i sæbevand og prøv om du kan lave en boble. Det kan du ikke, og eksperimentet viser derfor to ting:
For at forstå hvordan sæbe kan stabilisere en hinde af vand, må vi først forstå hvorfor en hinde af vand er så ustabil. Den vigtigste årsag er tyngdekraften. Hvis man fjerner påvirkningen fra tyngdekraften kan man godt lave relativt stabile hinder af rent vand. Det kan man f.eks. se i denne film som er optaget i en rumstation.
Nedenfor ses tegninger af en lodret væskehinde der viser hvordan tyngdekraften over tid gør hinden tykkere for neden og tyndere for oven. Det sker fordi tyngdekraften trækker vandet i hinden nedad. Sådan en tykkelsesforskel i hinden opstår i løbet af få sekunder.
Nedenfor ses tegninger af en lodret væskehinde der viser hvordan tyngdekraften over tid gør hinden tykkere for neden og tyndere for oven. Det sker fordi tyngdekraften trækker vandet i hinden nedad. Sådan en tykkelsesforskel i hinden opstår i løbet af få sekunder.
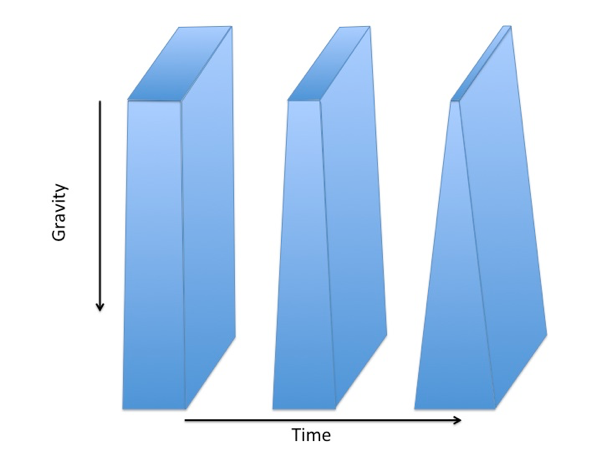
En lodret væskehinde ændrer tykkelse over tid. Hinden bliver tyndere i toppen og tykkere i bunden fordi tyngdekraften trækker væsken nedad.
En hinde af vand påvirkes også af en gensidig tiltrækning mellem vandmolekylerne i hinden. Det skyldes vandmolekylernes polaritet. Et vandmolekyle i hindens indre bliver tiltrukket af vandmolekyler fra alle sider rundt om det, og den gennemsnitlige tiltrækning vil derfor blive udlignet. Men den gennemsnitlige tiltrækningskraft på vandmolekylerne i hindens overflade vil være rettet ind med hindens indre fordi der ikke er en tilsvarende tiltrækning ud mod luften (der er kun en svag tiltrækning mellem molekylerne i væsken og i luften som vi kan se bort fra). Når en sæbehinde er tilstrækkelig tynd, så vil vandmolekylerne i hindens overflader begynde at tiltrække fra hinanden. Så vil både tyngdekraften og tiltrækningskraften mellem vandmolekylerne gøre hinden tyndere indtil den kollapser.

Overfladespænding i sæbebobler øges af vandet og sænkes af sæben
Det er i øvrigt også tiltrækningen mellem vandmolekylerne der skaber overfladespændingen som holder sammen på boblens overflade, og som resulterer i at en sæbehinde altid vil minimere sit overfladeareal. Tiltrækningen mellem vandmolekylerne skaber altså to forskellige fænomener: a) Overfladespænding som virker langs hindens overflade og som ikke afhænger af hindens tykkelse (læs mere om overfladespænding her). b) Tiltrækning mellem vandmolekylerne i de to overflader som virker på tværs af hinden. Denne tiltrækning opstår kun når hinden er tynd nok til at molekylerne i overfladerne kan "mærke" hinanden.
Sæbemolekyler er specielle ved at have en ”hale” som ikke tiltrækkes af vand. Derfor skubbes sæbemolekylerne som regel ud til overfladen af sæbevandet (sæbemolekylerne kan også danne lukkede strukturer inde i væsken for at minimere kontaktfladen med vand). Der er dog en del af sæbemolekylet som har en negativ elektrisk ladning og som derfor tiltrækkes af vand. Denne ende vil gerne omgås vandmolekylder, og det er derfor man alligevel godt kan lave blandinger af sæbe og vand i modsætning til f.eks. vand/olie eller vand/benzin.
En væskehinde af sæbevand bliver ligesom hinder af rent vand tyndet af tyngdekraften. Men i modsætning til vandhinden vil sæbehindens overflader frastøde hinanden på grund af de negative elektriske ladninger på sæbemolekylerne (se figuren nedenfor). En sæbehinde vil derfor blive tyndet ned til den tykkelse hvor hindens overflader begynder at ”mærke” frastødningen fra hinanden. Hvis den frastødende kraft fra sæbemolekylerne er stærk nok (f.eks. hvis der er nok sæbe i blandingen) til at overvinde tiltrækningen mellem vandmolekylerne og trækket fra tyngdekraften, så vil sæbehinden være stabil.
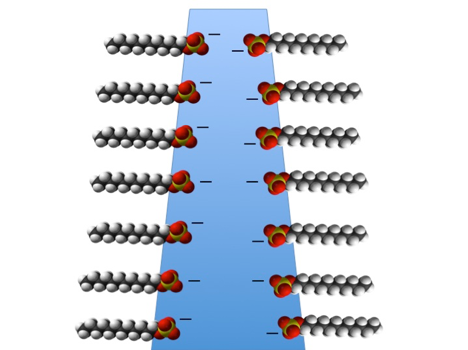
En simpel illustration af en lodret sæbehinde. Sæbemolekylerne stikkerhalen ud af væsken, og danner derved et elektrisk negativt ladet lag på hindens inderside.
Mellem sæbemolekylerne er der vandmolekyler (vist med blå farve). I områder hvor hinden er tynd nok, vil der opstå en frastødning mellem overfladerne på grund af frastødning mellem de negative elektriske ladninger. Dette stabiliserer sæbehinden og hindrer at den tyndes yderligere.
Hvis vi ser bort fra tyngdekraften, så kan de kræfter som virker på tværs af en sæbehinde beskrives matematisk ved hjælp af den såkaldte DLVO-teori (som er opkaldt efter Derjaguin, Landau, Verwey og Overbeek). Grafen nedenfor viser de såkaldte potentialer for kræfterne i en tynd væskehinde beregnet ud fra DLVO-teorien.
Den sorte linje repræsenterer potentialet for alle de tiltrækkende og frastødende kræfter på tværs af hinden. Du kan tænke på en graf over potentialer som om de tiltrækkende kræfter trækker linjen nedad mens de frastødende omvendt trækker den opad. Forestil dig en sæbehinde som først er tyk, måske en mikrometer (= 1000 nm = 0.001 mm) eller deromkring. Grafen viser hvad der sker når hinden tyndes. Vi starter altså langt ude til højre for grafen og bevæger os til venstre mod en tyndere og tyndere hinden. Når tykkelsen er ca. 50 nm bliver potentialet positivet. Det betyder at de frastødende kræfter begynder at virke. Hvis hinden når en tykkelse hvor de frastødende kræfter bliver større end trækket fra tyngdekraften, så vil hinden stabiliseres f.eks. ved en tykkelse omkring 30 nm. Sæbehinden kaldes så en common black film. Den er for tynd til at vise interferensfarver og er derfor sort på en sort baggrund (deraf navnet black film). Sæbehinden kan dog stadig tyndes, f.eks. ved fordampning af vand. Når hinden tyndes yderligere vil potentialet stige op til et maksimum (på grafen ved ca. 10 nm), og herefter falder potentialet hurtigt, når et minimum (omkring 5 nm) og stiger igen meget hurtigt (ved ca. 4 nm). Det betyder at de tiltrækkende kræfter vil dominere i et kort tykkelsesinterval under tykkelsen for en commen black film, indtil en ny stabil tykkelse opnås (omkring 4 nm). Dette er den såkaldte Newton black film (som er blevet observeret af selveste Isaac Newton, og har navn derfra). Alle de her nævnte hindetykkelser er realistiske for sæbehinder, men der forekommer selvfølgelig variationer som i høj grad afhænger af indhold og blandingsforhold i sæbevandet. I den videnskabelige litteratur er de rapporterede tykkelser for en common black film (5-200 nm) og for en Newton black film (3-5 nm).
Mens den sorte linje repræsentere summen af de positive og negative kræfter i hinden, repræsenterer den grønne linje de tiltrækkende kræfter fra vandmolekylerne og den røde linje frastødningen fra overfladerne (den såkaldte dobbeltslagsfrastødning). Den blå linje repræsenterer nogle kræfter som ikke er beskrevet ovenfor og som heller ikke er fuldstændig forstået i den videnskabelige litteratur. Men det er kræfter som spiller ind når hindens tykkelse er sammenlignelig med størrelsen af molekylerne i hinden. Derved bliver det vanskeligt at tynde hinden yderligere. Grafen viser hvilke af disse kræfter der dominerer for forskellige tykkelser.
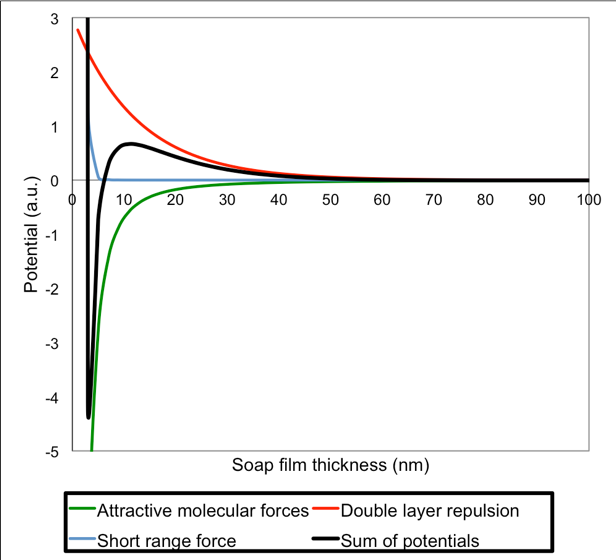
Graf over potentialer for tiltrækkende og frastødende kræfter som funktion af tykkelsen i en sæbehinde baseret på DLVO-teorien.
Et par ting bør måske nævnes her til slut: For det første, selvom grafen viser at potentialet stiger mod uendeligt for de mindste tykkelser, så betyder det ikke at en Newton black film er fuldstændig stabil. Det betyder bare at påvirkning af hinden snarere vil få den til at sprænge frem for at den tyndes. For det andet, indeholder de sæbebobler vi laver ofte relativt meget sæbe, og derudover måske også glycerin og andet der gør sæbebobleblandingen god. Strukturen af sæbehinder fra sådanne bobleblandinger er mere komplicerede end den vist ovenfor. Der vil f.eks. være såkaldte misceller og lavdelte strukturer af sæbemolekyler inde i hinden, og disse vil påvirke potentialet over hinden.
Læs mere i videnskabelige artikler, for eksempel:
Eller i bøger, for eksempel: