I et polært molekyle er der bare ikke tale om magnetiske poler, men om elektriske poler. Man kan derfor påvirke en sæbeboble med et elektrisk felt.

Et vandmolekyle (til højre) er polært ligesom en magnet (til venstre). Begge har en plus- og en minus-pol. For vandmolekylet er polerne dog ikke magnetiske, men elektriske.
Hvis man vil forstå hvorfor vandmolekyler er polære, så skal man tænke på de dele vandmolekylet består af. Vandmolekylet er sammensat af atomer, og et atom består af en kerne og et antal elektroner der er jævnt fordelt rundt om kernen. Kernen er elektrisk positiv, og elektronerne er elektrisk negative. I forhold til brint-atomerne har ilt-atomet en stor kerne. Den store ilt-kerne i vandmolekylet trækker flere elektroner til sig end de mindre brint-kerner. Derfor vil elektronerne omkring et vandmolekyle være forskubbet over mod ilt-atomet. Konsekvensen er at vandmolekylet har en minus-pol ved ilt-atomet og en plus-pol ved hvert brint-atom. Da vandmolekyler er polære, opfører de sig ligesom magneter. Et vandmolekyle kan derfor tiltrække andre vandmolekyler.
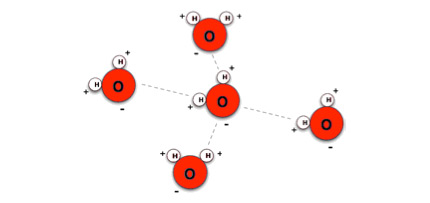
Vandmolekyler tiltrækker hinanden fordi de er polære.
Nu kan vi forstå vandets overfladespænding: Et vandmolekyle i et glas vand der ligger nede i væsken sammen med en masse andre vandmolekyler, bliver trukket i fra alle sider af de andre vandmolekyler. Det bliver trukket lige meget i fra højre, fra venstre, oppe fra og nede fra. Netto bliver molekylet derfor ikke trukket i nogen bestemt retning. Anderledes er det for et vandmolekyle der ligger i vandets overflade. Molekylet vil kun blive trukket i fra siderne og nedefra, men ikke ovenfra hvor der jo ingen vandmolekyler er. Trækket fra siderne udligner hinanden, men der er intet træk fra oven til at udligne trækket fra neden. Derfor bliver molekylet trukket ned mod væsken. Vandet vil altså hele tiden forsøge at trække vandmolekylerne væk fra overfladen og ned i væsken. Man kan derfor sige at vandet forsøger at få så få molekyler som muligt til at ligge i overfladen. Med andre ord vil vandet minimere sin overflade. Det er det som kaldes overfladespænding.
En vandoverflade er mindst mulig når den er helt flad. Hvis man laver buler i vandet som f.eks. når en skøjteløber sidder på en vandoverflade, så vil de polære kræfter forsøge at trække i den modsatte retning så bulerne kan blive udjævnet. Skøjteløberen flyder altså ikke, men bliver båret af vandets overfladespænding. Det er også overfladespændingen der bestemmer formen på dråber, vandbobler, sæbebobler og sæbehinder, og det er overfladespænding som holder sammen på en sæbeboble. Overfladespændingen vil altid minimere overfladen af en væske, f.eks. sæbevand. I en sæbeboble er der luft som trykker ud mod sæbehinden, mens overfladespændingen forsøger at gøre boblens overflade, og dermed boblen selv, så lille som muligt. Derfor bliver sæbehinden presset ind mod luften i boblen. Resultatet er at der opstår en balance mellem luftens tryk og trykket fra overfladespændingen i sæbehinden.

En skøjteløber jager fluer på overfladen af vand. Den kan gå på vandet fordi den holdes oppe af vandets overfladespænding. Tak til Lars Gabrielsen for lån af billedet.
Sådan kan man måle overfaldespænding
På figuren nedenfor er vist en metalbøjle med to pinde der stikker ned i en væske. Hvis man dypper bøjlen i en væske og trækker den op igen, så vil man trække en hinde op som vist på figuren. Væsken vil gøre lidt modstand overfor trækket, og den modstand skyldes overfladespænding. En fysiker vil sige at man udfører et stykke arbejde.

Det stykke arbejde kan beskrives matematisk som en konstant gange arealet af hinden:
Der ganges med 2 fordi hinden har to overflader. Den første konstant er overfladespændingen, og man kan bruge ligningen når man skal måle en væskes overfladespænding. Man skal bruge en vægt til at måle vægten af bøjlen når den trækkes op af væsken. Væsken vil trække bøjlen ned på grund af overfladespændingen, og man skal derfor blive ved med at lægge lodder på vægten lige indtil hinden på bøjlen sprænger.
Ved at isolere i formlen ovenfor og ved at indsætte definitionen af arbejde (), kan man beregne væskens overfladespænding:
Her er m den masse som måles med vægten, og g er tyngdeaccelerationen (9,8 m/s2). Man kan se ud fra formlen at overfladespændingen måles i SI-enhederne N/m (Newton delt med meter). Som regel bruger man dog enhederne dyn/cm. I tabellen kan man se et eksempel på målinger af overfladespænding der lavet på forskellige væsker af Soapbubble.dk. Her kan man se at forskellige væsker har forskellig overfladespænding. Læg mærke til at sæbevand har en lavere overfladespænding end rent vand.
Målte overfladespændinger
- Demineraliseret vand: 39,8 dyn/cm
- Forurenet vand (*): 32,1 dyn/cm
- Sæbevand: 30,8 dyn/cm
- Sprit: 27,4 dyn/cm
- *Vandet blevet forurenet ved at dyppe en finger i vandet umiddelbart før målingen.